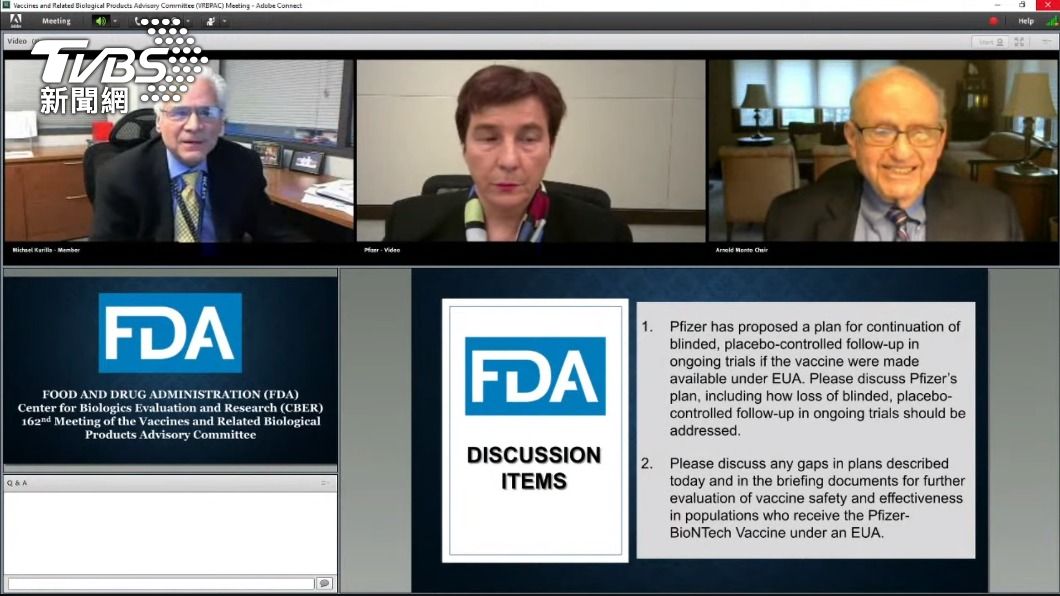
中央流行疫情指揮中心今(19)日宣布通過高端疫苗的緊急製造許可,不過在昨(18)日的審查會議上,其實21名專家扣除主席之外,有1人投不同票,被問到整個審查過程是否有錄影可以公開,指揮官陳時中則說怕會影響到專家的表意權,不過看看美國FDA審查輝瑞和莫德納疫苗時,包含討論以及投票,全程超過8小時都在YouTube公開直播。
國立政治大學法學院副教授劉宏恩在臉書上表示,既然是EUA緊急授權專案核准,是以緊急公衛需求為前提,是不是應該只允許短期的核准期間,或是限期在一定期間內完成第三期試驗申請藥證,並且附條件當緊急需求結束時此一核准可以廢止?因為衛福部新聞稿沒有說明核准期間有多長、是否限期申請藥證,也沒有說明是否附任何條件。這些資訊應該公開。

下方則有其他人士公開部分EUA資料,顯示高端疫苗核准製造期間,是自發文日起至中央流行疫情指揮中心解散為止,因此主管機關可以依照監測結果主動廢止或是疫情結束就自動廢止。
而這次審查的專家會議中有21名與會,扣除主席不參與投票,18人同意,1人補件再議,1人不同意,在記者會上有記者問到,是否可以得知此這名專家反對的原因為何?整個過程是否有錄影可以公開?
指揮官陳時中則說,社會對於這種審查的事情都會有很多的爭議,有1派會主張說全程公開,另外1派則是讓專家有表達的自由,這兩個都有優缺點,沒有誰好誰壞,全程公開誰又能保證沒有背後的交易?沒有公開大家也會質疑是不是就有操作的空間?錄影公開真的妨害到專家的表意權,有時候表達權力被剝奪,對結果可能不見得正確。

不過實際翻閱美國FDA在審查輝瑞BNT以及莫德納疫苗時,專家會議過程全程YouTube直播,官方頁面上也清楚表列完整EUA授權書、隨後的EUA修正案、決議備忘錄和完整會議紀錄。
對此《TVBS新聞網》詢問食藥署長吳秀梅,她表示專家都是非常專業,有時候也不想變成媒體焦點,以這樣的方式對他們來說不一定是公平的,而且每個國家的國情有一點不一樣,會議記錄未來等另一家結束審查後,會以「去識別化」的方式公開。至於高端的EUA有沒有期限?她說主要是配合指揮中心需求,但如果通過的但書,例如定時繳交施打報告等沒有做到,食藥署也會有動作。
《TVBS》提醒您:
因應新冠肺炎疫情,疾管署持續疫情監測與邊境管制措施,如有疑似症狀,請撥打:1922專線,或 0800-001922。
◤日本旅遊必買清單◢